

《Tumor公社》 肿瘤医学开放式媒体平台,打造肿瘤医学领域一站式解决方案,致力于为用户公众及患者提供及时、全面的肿瘤资讯、科普知识。看百科、找医生、指南分享、搭建医生与患者、患者与患者之间的桥梁,让更多人了解肿瘤、认识肿瘤、助力健康中国2030规划纲要,推动全面科学素质普及,共建肿瘤医学科普生态圈。




专注肿瘤专家报道,专注肿瘤人文报道,全面、细致、详实的让你了解每一位肿瘤领域大咖。

中国抗癌协会早癌筛查科普教育基地官方账号
支修益1,王洁2,刘伦旭3,赵军4,中国医药教育协会肺癌医学教育委员会,北京医学奖励基金会肺癌医学青年专家委员会,中国老年保健协会肺癌专业委员会 1. 首都医科大学宣武医院 胸外科 (北京 100053) 2. 中国医学科学院肿瘤医院 肿瘤内科(北京 100021) 3. 四川大学华西医院 胸外科( 成都(610041) 4. 北京大学肿瘤医院暨北京市肿瘤防治研究所胸部肿瘤内一科 恶性肿瘤发病机制及转化研究教育部重点实验室(北京100142) 通信作者:支修益,Email:xiuyizhi2015@163.com;王洁,Email: wangjie_cc@yahoo.com;刘伦旭,Email: lunxu_liu@aliyun.com;赵军,Email:ohjerry@163.com 关键词:肺癌;骨转移;骨改良治疗;临床指南;推荐意见 引用本文:支修益,王洁,刘伦旭, 等. 中国肺癌骨转移临床诊疗指南(2024版). 中国胸心血管外科临床杂志, 2024, 31(5): 643-653. doi: 10.7507/1007-4848.20240204
4.1.2.2 其他RANKL抑制剂
纳鲁索拜单抗是我国原研的全球首个全人源IgG4 RANKL抑制剂,是国家1类生物制剂。纳鲁索拜单抗与RANKL的亲和力较地舒单抗更强,结合效率提升2.5倍。已在肺癌骨转移患者中完成Ⅰ期及Ⅰb期临床试验。在骨巨细胞瘤关键Ⅱ期上市研究中,纳鲁索拜单抗对比地舒单抗显现出肿瘤反应率高,起效速度快的趋势[32]。
4.1.3 骨改良药物使用疗程及停药指征
虽然骨改良药物可在短时间内改善骨痛症状[33],但对于SREs则需要超过6 个月的治疗时间[34]。系统评价[35]发现,骨改良治疗超过2年,SREs风险降低,但ONJ 等不良反应的累积风险增加。因此骨改良药物不宜短期治疗,ASCO多发性骨髓瘤指南[36]认为,对于寡转移性疾病控制良好的患者在2年后中断双膦酸盐治疗可行,但其最佳使用时间目前尚无定论[27-38]。从临床经验的角度,如患者可耐受且治疗符合患者和医生共同治疗目标时,可酌情选择长期治疗。
出现严重不良反应或医生认为继续用药无法从治疗中获益是骨改良药物的停药指征。但如果双膦酸盐治疗期间骨痛加重或出现SREs时,应继续用药以降低二次SREs风险[5],也可以考虑换用地舒单抗或另外一种双膦酸盐,但仍需后续研究进一步明确。
4.1.4 不良反应及用药注意事项
双膦酸盐和地舒单抗都可引起ONJ、低钙血症和其他电解质异常以及非典型骨折等并发症。双膦酸盐独有的并发症包括肾功能不全、急性期反应、眼毒性、肌肉骨骼疼痛和心房颤动等;地舒单抗常见的不良反应为肌肉、骨骼疼痛,偶见蜂窝织感染等病例报道, ONJ和非典型性股骨骨折相对罕见[23]。
4.1.4.1 颌骨坏死
骨改良药物的使用是ONJ发生的危险因素之一,于2002 年首次描述。ONJ的特征表现为骨暴露和坏死,其可在数周、数月甚至数年内无症状;直至周围软组织发炎时病变出现相关症状,包括长时间的颌部疼痛、牙齿松动、骨膨大、牙龈肿胀、发红和溃疡。有些表现可能自发出现,也可能在既往牙科手术部位出现。ONJ继发感染后,还可能发生口内或口外瘘。ONJ主要发生机制尚不明确,但可能与严重且长期的骨吸收抑制伴骨重塑过度抑制以及感染有关[39]。
一项纳入4.2万例肿瘤患者的系统评价[40]指出,使用骨改良药物后发生ONJ的发生率为2.08%,地舒单抗的ONJ发生率略高于双膦酸盐(3% vs. 1.6%)。但也有研究[41]指出,更短的给药间隔也会增加双膦酸盐发生ONJ风险(5 周 vs. ≥ 5周)。地舒单抗治疗第1年ONJ发生率为1.1%,第2年为3.7%,随后每年为4.6%。因此,在开始进行骨改良药物治疗之前,推荐进行口腔检查,治疗期间应定期进行口腔检查,并给以适当的预防性牙科护理。患者在治疗期间应避免进行侵入性的牙科手术,如果必须进行可考虑暂停骨改良药物治疗。如出现ONJ,对于大部分患者建议最开始采用保守治疗(抗菌含漱剂、有临床指征时使用抗生素、有效保持口腔卫生,以及有限的清创),而不是积极的手术切除;关于ONJ患者是否停用骨改良药物,请参考4.1.3。
4.1.4.2 肾毒性
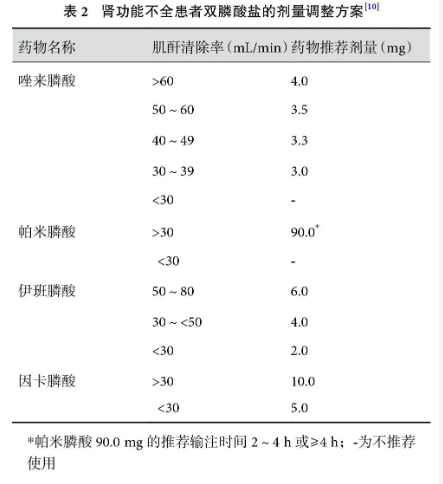
肾功能不全是双膦酸盐的常见不良反应之一,早期无明显症状,表现为蛋白尿或管型尿,少数可发展至急性肾衰竭[4]。但骨改良药物导致肾功能不全的数据多见于多发性骨髓瘤研究,肺癌骨转移人群鲜有报道。对于年龄>65 岁、合并糖尿病、服用非甾体抗炎药(NSAIDs)或正在进行含顺铂化疗的患者应当警惕肾功能不全甚至急性肾损伤的发生[4]。据文献[42]报道,一般肾功能不全中位发生时间为4.7~5.4 个月,当血清肌酐清除率<60 mL/min 时,出现急性肾功能不全风险显著升高。对于肾功能不全患者使用双膦酸盐需调整剂量(表2)。因卡膦酸给药后在肾脏沉积量更少,且易被快速清除,与唑来膦酸相比,可一定程度降低肾毒性风险。RANKL抑制剂(地舒单抗)分子量大于肾小球滤过阈值,几乎不经肾脏消除。因此,既不需要也不推荐对既存肾损伤患者监测肾功能和调整剂量。
4.1.4.3 低钙血症
不同骨改良药物的低钙血症发生率有差异,如唑来膦酸发生率为5%~10%,伊班膦酸为1%~10%,地舒单抗为18%。虽然轻度和/或慢性低钙血症几乎没有症状,但重度或急性低钙血症会引发抽搐、支气管痉挛等急症,甚至危及生命。因此在给予地舒单抗前,有必要常规监测低钙血症并将其纠正,甚至预防性补钙。有证据表明,骨改良药物服用期间补钙(含维生素D),可显著降低低钙血症风险[43]。因此,除非有高钙血症等禁忌证,推荐使用骨改良药物的患者额外补充1 000 mg 钙及800~1 200 IU 维生素D。
4.2 全身治疗
由于绝大多数肺癌骨转移患者为肺癌晚期,常多发骨转移灶,为了延长总生存期,同时维持生存质量,晚期非小细胞肺癌(NSCLC)一般需要序贯系统治疗和辅助性镇痛治疗,并优先于外科和放疗等局部治疗[44]。在肺癌的系统性治疗中,传统化疗依旧重要,但基于生物标志物的个体化治疗和免疫检查点抑制剂等新策略正逐渐受到重视,并探索出多种联合治疗方案。然而,由于骨转移的复杂生物学特性和评估困难,并没有特殊的内科治疗药物能特异性改善骨转移的疗效,减轻SREs 的发生,更多的是需要MDT。
4.2.1 化疗
无论是小细胞肺癌还是NSCLC骨转移,均强调综合治疗策略的重要性。传统化疗长期以来一直是标准治疗,选择化疗方案时应考虑患者的全身状况和肿瘤的生物学特性。铂类药物为基础的双联方案是此类患者一线化疗的主要选择,可根据患者耐受性和疾病特点调整。
4.2.2 免疫治疗
基于生物标志物的个性化疗法和免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)为治疗提供了新方向,但骨转移通常不会被列入亚组分析。NSCLC患者在发生骨转移时,对ICIs的治疗反应表现出明显的复杂性。部分研究[45-46]显示预后恶化,而有些研究[47-49]发现骨转移对生存影响不明显。这种差异可能源于骨的免疫微环境[45,47-49]和骨转移的生物学差异[50]。但如果ICIs与RANKL抑制剂(地舒单抗)联合应用时,相比ICIs单药,抑制晚期NSCLC患者骨转移的进展效果更优,延长总生存期。
为提升骨转移相关NSCLC患者疗效,综合运用化疗联合其他治疗比如抗血管生成疗法、ICIs和骨改良药物成为趋势[51]。但骨转移的独特性,如特定微环境、评估挑战以及生物学异质性和PD-L1的动态表达,使治疗过程复杂化,目前仍然难以给出前瞻性、个体化的方案。
4.2.3 靶向治疗
骨转移在NSCLC中与多器官转移、频繁的复发性突变及复杂基因异常相关。既往文献[4]报道表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)对骨转移表现出治疗潜力,例如TKIs可以通过调节骨髓基质细胞(BMSC)降低破骨细胞的分化,从而延缓肿瘤骨转移病灶的骨破坏,进而减少SREs,延长首次SREs 时间;但出现骨转移仍是不良预后的独立危险因素。现行治疗倾向于整合靶向治疗、双膦酸盐及骨吸收抑制剂来优化治疗[4]。
4.2.4 抗血管生成治疗
在NSCLC骨转移的抗血管生成治疗研究中,有研究[4]揭示贝伐单抗对NSCLC骨转移的特异性疗效,贝伐单抗组患者的骨转移反应率和疾病控制率显著提高。对比先前关于唑来膦酸的研究,含贝伐单抗的化疗方案可能对骨转移反应率更高。
4.3 镇痛治疗
由于骨受累是癌症相关性疼痛的主要原因之一,也是晚期恶性肿瘤患者出现重度疼痛的主要原因[52]。肺癌骨转移疼痛的处理应优先采用病因治疗、药物和非药物协同镇痛的原则,及早按阶梯、个体化给药,同时预防和控制药物不良反应。病因治疗是指针对肺癌的抗肿瘤治疗,非药物治疗包括放疗、手术和介入治疗等局部治疗[53-54]。对于局限性骨痛,可考虑局部放疗、神经阻滞术、椎体成形术或经皮消融术等。当骨转移疼痛局限于一处或少数几处时,也可以使用外照射的方法[4],具体可参见4.4.1。本小节主要介绍肺癌骨转移疼痛的药物治疗。
4.3.1 疼痛评估
对于肺癌骨转移合并疼痛的患者,充分进行疼痛评估是镇痛治疗的前提。癌痛评估应遵循四大原则:常规、量化、全面、动态[55]。常规评估中需特别注意鉴别是否有因病理性骨折或脊髓压迫等引起的爆发痛。量化评估有数字分级法、主诉疼痛程度分级法、面部表情评估量表法和简明疼痛评估量表等。
4.3.2 药物镇痛
4.3.2.1 非甾体类抗炎药和对乙酰氨基酚
轻度疼痛优选此类药物,常见的有阿司匹林、布洛芬和塞来昔布等。对乙酰氨基酚最大用量不宜超过4 g/d。对于局部关节疼痛可外用NSAIDs,如1% 双氯芬酸钠凝胶,每日4 次;或1.3%双氯芬酸贴剂,1~2片/d。
4.3.2.2 阿片类药物
阿片类药物是肺癌骨转移患者中至重度疼痛的一线镇痛用药。阿片类药物剂量换算及不良反应处理详见《肺癌骨转移诊疗专家共识(2019 版)》[4]。这些药物可预防骨相关事件并提高生存质量。在疼痛得到有效缓解后,应考虑逐步减少或完全终止阿片类药物的使用。建议采用逐渐减量法,即每日按10%~25%的比例递减药物剂量,直至达到日剂量相当于30 mg口服吗啡的药量。此剂量水平维持2 d 后,方可考虑停止阿片类药物治疗。
4.3.2.3 辅助镇痛药
若患者对阿片类药物的反应欠佳,则考虑联合辅助镇痛药物。骨改良药物、糖皮质激素(如强的松、地塞米松)、局部麻醉药(如利多卡因)、抗惊厥类药物(如加巴喷丁、普瑞巴林)、镇痛性抗抑郁药(如度洛西汀、米那普仑)、骨靶向放射性核素药物[如锶-89(89Sr) ]等均属于此类。
骨改良药物可改善肿瘤骨组织的酸性微环境、遏制骨溶解,并减少镇痛药的使用量[56]。因此,如肺癌骨转移的患者伴有强烈骨痛,我们推荐使用骨改良药物联合阿片类药物。糖皮质激素可能对阿片类药物难治性骨痛患者有用,特别是神经压迫的患者。骨靶向放射性核素可用于难治性多灶性骨痛患者,详见4.4.3。
4.4 放射治疗
4.4.1 外照射
外照射是治疗单纯性骨转移的标准治疗,可使50%~80% 的患者疼痛缓解,多达1/3的患者实现疼痛完全缓解。外照射前因进行评估体能状态评分,并明确骨转移灶的部位。对于单纯骨转移,美国放射肿瘤学会(ASTRO)和欧洲肿瘤内科学会(ESMO)[57]认为,单次8 Gy方案和分割方案的疼痛缓解效果相同,且可能更方便、性价比更高,即便有的患者需要再次外照射治疗。外照射适应证、剂量及分割方式见《肺癌骨转移诊疗专家共识(2019版)》[4]。
4.4.2 立体定向放射治疗
近年来,SBRT逐渐在临床普及,相比外照射提高了患者的局部控制率,SBRT对小体积骨寡转移患者优势更为明显,可显著缓解骨转移引起的疼痛症状[4],尤其是有椎骨转移。但SBRT也可能会增加椎骨压缩骨折的风险。因此,SBRT应主要用于期望寿命较长(>6个月),在标准疗程外照射后仍有骨痛或骨痛复发,并需要再次照射的患者。
4.4.3 骨靶向放射性核素
骨靶向放射性核素是放射性亲骨性分子,目前已获批用于缓解成骨性骨转移患者的疼痛。一般来讲,骨靶向放射性核素治疗更适用于经外照射和/或其他形式治疗后仍有疼痛或疼痛复发的多灶性骨痛患者,而不是作为初始治疗。
89Sr是常用的放射性核素,能够发射β粒子,可有效缓解疼痛,缓解率为40%~95%。关于89Sr的适应证、用法用量和禁忌证等见《肺癌骨转移诊疗专家共识(2019 版)》[4]。此外,镭-223(233Ra)是一种新型的经静脉注射的骨靶向放射性同位素,可发射α粒子;目前在前列腺肿瘤骨
推荐阅读