

《Tumor公社》 肿瘤医学开放式媒体平台,打造肿瘤医学领域一站式解决方案,致力于为用户公众及患者提供及时、全面的肿瘤资讯、科普知识。看百科、找医生、指南分享、搭建医生与患者、患者与患者之间的桥梁,让更多人了解肿瘤、认识肿瘤、助力健康中国2030规划纲要,推动全面科学素质普及,共建肿瘤医学科普生态圈。




专注肿瘤专家报道,专注肿瘤人文报道,全面、细致、详实的让你了解每一位肿瘤领域大咖。

中国抗癌协会早癌筛查科普教育基地官方账号
支修益1,王洁2,刘伦旭3,赵军4,中国医药教育协会肺癌医学教育委员会,北京医学奖励基金会肺癌医学青年专家委员会,中国老年保健协会肺癌专业委员会 1. 首都医科大学宣武医院 胸外科 (北京 100053) 2. 中国医学科学院肿瘤医院 肿瘤内科(北京 100021) 3. 四川大学华西医院 胸外科( 成都(610041) 4. 北京大学肿瘤医院暨北京市肿瘤防治研究所胸部肿瘤内一科 恶性肿瘤发病机制及转化研究教育部重点实验室(北京100142) 通信作者:支修益,Email:xiuyizhi2015@163.com;王洁,Email: wangjie_cc@yahoo.com;刘伦旭,Email: lunxu_liu@aliyun.com;赵军,Email:ohjerry@163.com 关键词:肺癌;骨转移;骨改良治疗;临床指南;推荐意见 引用本文:支修益,王洁,刘伦旭, 等. 中国肺癌骨转移临床诊疗指南(2024版). 中国胸心血管外科临床杂志, 2024, 31(5): 643-653. doi: 10.7507/1007-4848.20240204
摘 要
肺癌居中国恶性肿瘤发病之首,骨转移是肺癌常见转移部位之一。随着影像学和核医学技术不断进步,骨转移早诊水平均有所提高。针对肺癌骨转移全身系统治疗(化疗、靶向治疗、免疫治疗)以及骨改良药已有更多循证依据和进展。多学科(肿瘤内科、外科、放疗、介入、核素、心理康复等)指导下的综合治疗模式已经日趋成熟。鉴于此,中国医药教育协会肺癌医学教育委员会、北京医学奖励基金会肺癌青年专家委员会、中国老年保健协会肺癌专业委员会在 《肺癌骨转移诊疗专家共识(2019版)》的基础上,制定了《中国肺癌骨转移临床诊疗指南(2024版)》,旨在提升我国肺癌骨转移的综合治疗水平。
正 文
肺癌是骨转移最常见的实体瘤类型[1]。数据[1]表明,肺癌患者出现骨转移的平均时间为 9 个月,约 2/3 在肺癌诊断时即已发生,即同时骨转移(synchronous bone metastasis,SBM)。近期我国一项大型回顾性流行病学调查研究[2]发现,肺癌患者中有17.42%出现SBM,中位生存期为11.53 个月, 1年、2年和5 年的总体生存率分别为51%、17%和8%。因此,在肺癌确诊的同时,应密切留意肺癌骨转移,推荐对肺癌高危骨转移人群进行常规筛查。
骨转移不仅影响患者日常生活,还会发生骨痛、病理性骨折、脊髓和神经压迫、钙盐和磷酸盐平衡紊乱等骨相关事件(skeletal related events, SREs)。20%~30%的晚期肺癌骨转移患者在诊断时即已发生SREs[3];也有数据[1]表明,肺癌患者骨转移的SREs 发生率高达 53.4%,如不积极治疗,中位生存时间仅为10 个月。因此,肺癌患者应在积极治疗原发病的同时,规范使用骨改良药物,以积极应对SREs 的发生发展。
此外,肺癌骨转移不仅是SREs的防治,也需要多学科全身治疗与局部治疗相结合,在强化骨转移症状控制的同时综合考量患者心理因素,强调肿瘤患者身心并重的整体治疗。
1 指南制定方法
中国医药教育协会肺癌医学教育委员会、北京医学奖励基金会肺癌医学青年专家委员会、中国老年保健协会肺癌专业委员会于2023 年 4 月正式成立《中国肺癌骨转移临床诊疗指南(2024 版)》工作组,在《肺癌骨转移诊疗专家共识(2019 版)》[4]基础上修订并升级为指南,历经10个月讨论,确定了章节构架、循证更新,再经过反复论证、统稿、审校,最终成稿。本指南采用GRADE方法评价证据质量、GRADE推荐作为推荐强度分级标准[5],针对肺癌骨转移多学科诊疗模式(multi-disciplinary treatment,MDT)提出12 条推荐意见,以期规范日益发展的骨改良治疗,提升肺癌骨转移综合防治水平。
2 病理与发病机制
肺癌骨转移的特征是破骨细胞活化导致的骨破坏,病理上以溶骨性病变居多。一旦骨骼中出现肿瘤细胞,则肿瘤细胞、成骨细胞及破骨细胞之间的相互作用会形成恶性循环,使骨转换增加,从而导致溶骨性破坏并促进恶性肿瘤细胞生存。活化的成骨细胞可刺激核因子-κB受体活化因子配体(receptor activator for nuclear factor-κB ligand, RANKL),RANKL与核因子-κB 受体活化因子受体(receptor activator for nuclear factor-κB,RANK)相互作用激活破骨细胞,激活的破骨细胞随后使骨再吸收,导致骨溶解,同时释放生长因子诱导肿瘤细胞持续生长。可见,RANKL/RANK是介导肺癌骨破坏的关键通路[6]。此外,RANKL可能作为趋化因子,与表达RANK的肿瘤细胞直接作用,促使肿瘤细胞向骨组织归巢[6-7]。
3 诊断
肺癌骨转移检测对准确分期和指导治疗至关重要。目前公认的骨转移诊断标准为临床确诊肺癌,骨活检阳性或有明确的骨转移影像诊断。影像学检查用于确定骨转移部位,以及评估受累部位是否存在病理性骨折和/或脊髓压迫(或是存在的可能性);必要时还可用于引导活检。
推荐1:对于确诊肺癌患者且有骨转移高危因素,初筛应首选放射性核素骨显像(bone scintigraphy,BS),特别是有骨转移的高危人群(如骨痛、高钙血症、高碱性磷酸酶、脊髓压迫症状等)(1A)。
推荐2:对于初筛BS阳性的肺癌患者,有必要行CT、磁共振成像(MRI)、正电子发射计算机断层显像/计算机断层显像(positron emission computed tomography/computer tomography, PET/CT)或骨活检进一步评估转移病灶,进一步明确诊断(2A)。
推荐3:肺癌如仅出现孤立性骨破坏病灶,应积极行病灶骨活检;如确诊肺癌,伴全身多发骨破坏,则不必进行骨活检(1A)。
3.1 诊断方法
3.1.1 放射性核素骨显像
BS通常被称为骨扫描,原理是利用示踪剂(一般为99mTc)在成骨细胞活性增加的部位蓄积的特性,反映骨代谢变化,进而提示肺癌骨转移的早期存在。临床研究[8]表明,BS检测骨转移兼具敏感性(79%~86%)和特异性(81%~88%),全身成像不易漏诊。因此,推荐其作为肺癌骨转移的优选初筛检测,特别是有骨转移的高危人群(如骨痛、高钙血症、高碱性磷酸酶、脊髓压迫症状等)。
但BS 无法检测骨髓受累情况,且非转移性骨病变可出现假阳性[9]。故BS需要联合其他影像手段,才能进一步提高诊断准确性。此外,在骨转移治疗后随访中,应注意不要将修复性成骨细胞活动造成的闪烁现象(flare phenomenon)误诊为疾病进展,故BS不常规推荐用于评价疗效。
3.1.2 PET/CT和PET/MRI
PET/CT 具有更高的空间分辨率,不仅反映全身骨骼受累情况,还可识别更小的病灶。
PET/CT诊断骨转移的特异性显著高于BS[10];F-氟脱氧葡萄糖(18F-FDG) PET/CT对于溶骨性及骨髓的转移最敏感,而18F标记氟化钠(18F-NaF) PET/CT对于成骨性转移最敏感,但炎症或创伤后修复等可能导致假阳性[4]。18F-FDG PET/CT和18F-NaF PET/CT对于肺癌骨转移的疗效评价准确率较高。但考虑到价格和可及性,一般不推荐常规PET/CT作为肺癌骨转移的初始筛查手段,除非怀疑肺癌有除骨骼以外的多发转移。
PET/MRI 作为目前最高端的融合影像设备,集成了MRI高软组织分辨率、多参数、多序列、低辐射和PET 功能代谢的优势,可以提高阅片者对骨转移的诊断信心,特别是针对早期骨髓浸润和PET 摄取较低的骨病变。但PET/MRI 对于骨硬化病变特异性较低,且价格高昂,不适合临床常规应用。
3.1.3 X线
X线检查由于空间分辨率高、操作简单、费用低廉、辐射较小、有一定特异性[11],临床上常用于骨痛患者的初步影像学检查。骨病灶在X线摄影上可能表现为低骨密度或无骨密度区(骨溶解),骨小梁结构破坏或缺失,或者硬化性病变或边缘。骨质破坏必须达到一定程度(骨密度降低30%~75%),才能在X线片上出现明显病变,因此X线平片相比BS和PET/CT,对早期骨转移瘤的诊断往往特异性较高但敏感性较低[12],比BS显示的骨转移灶晚3~6 个月。当骨髓内转移未累及皮质时,易被高密度皮质掩盖而漏诊;对于早期溶骨性骨质破坏者,当患者伴发骨质疏松症或其他低密度骨质疾病时,X线检查不易鉴别,故不推荐X线作为骨转移的早期筛查手段。
3.1.4 CT
与X线相比,CT可更好地显示骨的细节,实现骨皮质的高分辨率显像,对骨质破坏及其周围软组织肿块的识别更精准。CT的敏感性与BS 接近,一项Meta分析[13]调查了各种影像学方法对诊断多种恶性肿瘤骨转移的作用,就检测单个病灶而言,CT的敏感性和特异性分别为77% 和83%,而骨扫描分别为75%和94%。因此,推荐对于BS检查阳性而X线平片阴性患者进行CT检查明确诊断;由于CT在骨破坏尚未达到X线片能够检出的程度之前就能检测到骨髓中的溶骨性和成骨性转移,故当怀疑转移瘤位于脊髓时,也推荐行脊柱CT观察椎体稳定性。
CT影像也有助于制定放疗或手术方案。当需要了解骨转移瘤与周围神经、血管结构的关系时可考虑使用增强CT[4]。对于部分成骨性转移的鉴别,有文献[14-15]报道使用能谱CT检查有一定意义。但对于骨皮质的早期转移、骨转移骨髓质的浸润,尤其是在伴有骨质疏松的情况下,CT诊断的敏感性相对较低[16]。
3.1.5 MRI
MRI是唯一可以直接显示骨髓腔及其组成结构的成像方法,是检测骨髓病变最敏感的技术[17]。骨转移早期,在成骨细胞或破骨细胞活化而发生骨质变化之前,MRI即可对髓内的早期转移敏感性较高,是诊断和鉴别诊断骨髓转移的首选影像学方法。MRI 检查转移灶的敏感性高于CT,可更准确地确定肿瘤范围,并且对脊柱转移患者尤为有用,可评估髓内和脊柱外病变范围。MRI的准确性高于CT或BS,诊断骨转移的准确性与FDG-PET/CT相当[13]。因此,当BS 和X线无法确诊,特别是对怀疑髓内及脊髓受累的患者,推荐行MRI[4]检查。
3.1.6 治疗监测的影像学评价
骨转移的治疗监测中,X线、CT、BS 及MRI 等均是重要的影像学检查手段。目前尚无统一的疗效评价标准,RECIST 1.1疗效评价有一定局限性,可以参照MD Anderson标准[18]来评价骨转移;见表1。当成骨性转移诊断、评价困难时,可用MRI[19]或PET/CT[20]辅助。

3.1.7 骨活检
确诊肺癌骨转移的金标准是骨活组织的病理检查。如仅出现孤立性骨破坏病灶,无论有无肺癌均应积极行病灶骨活检;如确诊肺癌,伴全身多发骨破坏,则骨活检为非必须操作[4]。
穿刺活检是一种很好的获取足够组织的方法,足以明确是否存在转移性病变。CT引导下细针抽吸活检操作简单且结果准确,在极少数情况下可能需要开放活检[4]。通常情况下,穿刺活检不会引起病理性骨折的发生。穿刺活检取材要求及活检标本的处理方法详见《肺癌骨转移诊疗专家共识(2019 版)》[4]。
3.2 诊断流程
当肺癌患者合并骨转移高危因素时,应及时进行BS 筛查,如BS 阳性,则有必要行MRI、PET/CT或骨活检进一步评估转移病灶,进一步明确诊断。诊断流程见图1。
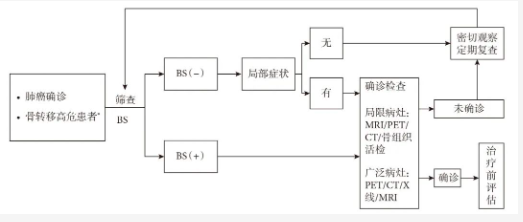
图 1 肺癌骨转移的诊断流程
BS:核素骨显像;PET/CT:正电子发射计算机断层显像;MRI:磁共振成像;*高危患者指骨痛、高钙血症、高碱性磷酸酶、脊髓压迫症状等
4 治疗
肺癌骨转移的防治目标为症状缓解、预防或延缓SREs、最终延长生存期并提高生活质量;必要时还应进行心理干预。
肺癌骨转移的治疗推荐遵循MDT制定个体化方案。推荐以肺癌的全身治疗为主,同时联合双膦酸盐和RANKL抑制剂等骨改良药物,预防和延缓SREs;对症止痛治疗可缓解症状,改善生活质量;此外,包括手术和放疗在内的局部治疗可以更好地控制骨转移相关症状。
推荐4:对确诊肺癌骨转移患者,推荐MDT,个体化制定综合治疗方案(1A)。
推荐5:对确诊肺癌骨转移患者,如无禁忌证,均推荐应用骨改良药物治疗(1A),但不推荐常规使用骨改良药物作为预防性治疗(2B)。
推荐6:如无禁忌,推荐双膦酸盐或RANKL抑制剂降低肺癌骨转移患者的SREs风险(1A)。
推荐7:正在接受双膦酸盐治疗的患者,如出现二次SREs不建议立即停用双膦酸盐(1B),也可以考虑换用RANKL抑制剂或另外一种双膦酸盐(2B)。
推荐8:在接受骨改良药物前后,均应常规检查口腔,以降低颌骨坏死(osteonecrosis of the jaw,ONJ)风险(1B)。
推荐9:对于多发性骨转移患者,应优先考虑全身系统治疗和及早、持续、有效地进行阶梯镇痛(1C)。
推荐10:对经全身治疗后仍无法改善的顽固性骨痛、病理性骨折和脊髓压迫的患者,局部体外放射治疗,特别是立体定向放射治疗(SBRT)应作为首选治疗(1B)。
推荐11:对于全身治疗有效、但局部或孤立性骨转移病灶、有脊柱受累的患者,可在外科充分评估的情况下进行外科干预(2B)。
推荐12:对于肺癌溶骨性骨转移病灶,可使用消融联合骨成形术(骨水泥)的介入治疗,控制转移病灶的同时恢复骨结构的稳定性(2B)。
4.1 骨改良药物
肺癌骨转移确诊后应立即进行骨改良药物治疗。骨改良药物也被称为“破骨细胞抑制剂”,临床常用的骨改良药物为双膦酸盐类和RANKL抑制剂。
4.1.1 双膦酸盐
在肺癌骨转移患者中,双膦酸盐常与抗肿瘤治疗联合使用,是骨改良的基础用药之一。双膦酸盐通过抑制破骨细胞活性而减少骨质吸收和增加矿化,阻止肿瘤转移引起的溶骨型病变、减少骨吸收、减轻骨痛及由骨转移所致的高钙血症及其他SREs[21-22]。目前,双膦酸盐类药物已经发展至第三代,以唑来膦酸、伊班膦酸钠和因卡膦酸二钠为代表;相比前两代,除减轻症状、延缓SREs 获益外,还可显著降低高钙血症风险、提升骨密度、改善骨代谢。伊班膦酸负荷剂量可快速缓解骨转移患者的疼痛[4,23-24]。因卡膦酸相比其他第三代双膦酸盐,发热、肾毒性及下颌骨坏死等不良反应发生率更低[25]。各类双膦酸盐药物的用法用量详见《肺癌骨转移诊疗专家共识(2019 版)》[4]。
4.1.2 RANKL抑制剂
在恶性肿瘤骨转移的过程中,RANK/RANKL是关键通路,因而针对骨转移的治疗,靶向RANKL是一个很好的选择。
4.1.2.1 地舒单抗
地舒单抗是RANKL抑制剂的代表药物,靶向抑制破骨细胞的分化、活化,打破癌症骨转移的恶性循环过程[26]。虽然目前没有地舒单抗与双膦酸盐在肺癌骨转移人群中的头对头比较研究,但在其他肿瘤骨转移研究中,地舒单抗相比双膦酸盐可延长首次出现SREs 的时间,显著降低首次SREs 发生风险,显著延缓病理性骨折、骨手术和/或骨放疗及脊髓压迫,延缓恶性高钙血症发生时间,部分研究[24,27-30]显示可延长生存时间,生存质量也更有优势[31]。地舒单抗目前已经获批在中国上市,用于预防实体瘤骨转移和多发性骨髓瘤引起的SREs,推荐的使用方法为皮下给药,每4 周1次,每次120 mg。
<br style="margin: 0px; padding: 0px; outline: 0px; max-width: 100%; box-sizing: border-box !important; overflow-wrap: brea