

《Tumor公社》 肿瘤医学开放式媒体平台,打造肿瘤医学领域一站式解决方案,致力于为用户公众及患者提供及时、全面的肿瘤资讯、科普知识。看百科、找医生、指南分享、搭建医生与患者、患者与患者之间的桥梁,让更多人了解肿瘤、认识肿瘤、助力健康中国2030规划纲要,推动全面科学素质普及,共建肿瘤医学科普生态圈。




专注肿瘤专家报道,专注肿瘤人文报道,全面、细致、详实的让你了解每一位肿瘤领域大咖。

中国抗癌协会早癌筛查科普教育基地官方账号
原发性肝细胞癌是全世界常见的恶性肿瘤之一,每年一半的新发肝癌发生在中国。大量临床研究和实践证明早筛和早诊可有效降低肝癌的 5 年总病死率。因此探索建立适合中国国情的肝癌筛查策略极其迫切。全国多中心前瞻性肝癌极早期预警筛查项目(Prospective suRveillance for very Early hepatoCellular cARcinoma,PreCar)专家组基于国内外主要相关指南、临床实践和 PreCar 项目研究最新进展,提出了中国早期肝癌筛查策略和具体流程,旨在为早期肝癌筛查和诊断提供实际方法,提高我国防控水平。
中国肝癌早筛策略专家共识
正文
原发性肝细胞癌(hepatocellular carcinoma,HCC)是全世界常见的恶性肿瘤之一,也是慢性肝病患者最常见的死亡原因,是我国癌症死因的第二位 [1 - 2] 。我国是肝癌大国,全世界一半左右的肝癌发生在中国 [3] ,肝癌的五年总生存率目前仅为 14.1% [4] ,每年的肝癌发病率和病死率非常接近 [5] 。肝癌长期生存率低的主要原因,首先在于肝癌高危人群筛查没有普及,早期诊断率低,导致 70% ~ 80% 的患者在诊断时已经是中晚期,如果能够早期发现和早期诊断,可以施行肝切除术和肝移植等根治性手段,可明显改善肝癌患者预后;其次,肝癌切除术后 5 年复发转移率高达 40% ~ 70% [5] 。
现有的诊疗策略和措施对降低肝癌的 5 年总病死率非常有限,因此探索新的肝癌筛查、诊疗策略极其迫切。全国多中心前瞻性肝癌极早期预警筛查(Prospective suRveillance for very Early hepatoCellular cARcinoma,PreCar)项目专家组查阅国内外大量文献,结合临床实践以及肝癌肝病相关的规范、指南和专家共识,对肝癌早期筛查的策略和流程进行了充分调研讨论,并形成了共识意见,旨在进一步改进风险人群早期肝癌发病预警、筛查和诊断方法,增强检查针对性并提高患者依从性,从而提高肝癌早期诊断率,实现早治获益。本共识中“肝癌”指“HCC”。
一、目标人群
据 Globocan 2020 数据统计 [6] ,中国 2020 年原发性肝癌发病率居恶性肿瘤第 5 位,新增 41 万例,其中男性 30.3 万例,年龄标化发病率(ASIR)分别为男性 27.6/10 万、女性 9.0/10 万 ;近 5 年全球肝癌平均年发病例数为 99.5 万例,其中中国 42.3 万例,占全球 42.5%。尽管近年我国肝癌发病率和病死率呈下降趋势,但由于人口基数大、老龄化等因素,肝癌负担仍较为严重,肝癌人群筛查有其必要性和紧迫性。
全球肝癌发病平均年龄存在地区差异,亚洲和非洲国家发病年龄多为 30 ~ 60 岁,肝癌 BRIGDE 研究结果表明中国、日本、韩国,欧洲和北美洲肝癌的平均发病年龄分别为 52、69、59、65 岁和 62 岁 [7] 。根据国家癌症中心 2019 年发布的数据,2015 年全国肝癌发病率随年龄增长而逐渐增加,30 岁以下年龄组发病率保持较低水平,30 岁及以后开始快速升高,80 ~ 84 岁年龄组发病率达到高峰,男性发病率(38.98/10 万)明显高于女性(14.26/10 万) [3] 。
中国一项纳入 2016 至 2018 年间 14 891 例肝癌的研究结果显示 [8] ,≤ 39 岁、>40 ~≤ 49 岁、>50 ~≤ 59 岁、> 60 ~≤ 69 岁和≥ 70 岁患者占比依次为 2.89%、14.59%、29.47%、35.26% 和 17.79% ;男女患病比例分别为 76.01% 和 23.99%;40 岁开始,特别是男性,肝癌发病率明显升高。
肝癌有明确的病因和危险因素,如乙型肝炎病毒(HBV)感染、丙型肝炎病毒(HCV)感染、酒精(乙醇)、非酒精性脂肪肝病(NAFLD)、致癌物暴露和糖尿病等。各种原因导致的肝硬化是肝癌发生过程中最重要的环节,85% ~ 95% 的肝癌具有肝硬化背景 [9] 。慢性 HBV 相关肝硬化患者肝癌年发生率为 3% ~ 6%,是我国肝癌的首要病因 [10] 。随着基础和临床研究的进步,HBV 和 HCV 被有效抑制或根除,NAFLD 相关肝癌的发病率呈上升趋势,在欧美正在成为肝癌的重要病因 [11 - 12] ,这导致了肝癌风险人群的变迁;据统计,我国普通人群 NAFLD 患病率为 15%(6.3% ~ 27.0%) [13] 。
我国《原发性肝癌诊疗规范(2019 年版)》 [14] 把年龄 > 40 岁的男性定义为肝癌风险更大的群体,推荐腹部超声联合甲胎蛋白(AFP)间隔 6 个月检查 1 次。《中国临床肿瘤学会原发性肝癌诊疗指南(2019)》推荐对于男性 35 岁以上、女性 45 岁以上的肝癌高危人群,应定期进行筛查。日本实施乙型肝炎、丙型肝炎筛查计划,在确诊的肝癌患者中巴塞罗那分期(BCLC)A 期肝癌占 60% ~ 65% [15],显著高于全球早期肝癌诊断率的 10% ~ 30% [16] ,这说明分层监测有利于提高肝癌的早期诊断率。根据我国肝癌流行病学、规范和指南,我们推荐筛查的目标人群为慢性肝病或有肝癌家族遗传史者,尤其是 40 ~ 75 岁的男性。
二、筛查方法
1. 肝癌风险评估 :
临床上已有多个多参数模型用于评估人群发生肝癌的风险,包括肝硬化背景下肝癌发生风险的多伦多风险指数(Toronto HCC risk index,THRI) [17] ;未接受抗病毒治疗的 HBV 感染者发生肝癌的 REACH - B 风险模型 [18] 、AGED 模型[19] ;接受 HBV 抗病毒治疗后肝癌风险预测的 PAGE - B 模型 [20] 、mPAGE - B 模型 [21] 及 SAGE - B 模型 [22] ;未经治疗的 HCV 感染者发生肝癌风险模型 [23 - 24] 及抗 HCV 治疗后的肝癌风险模型 [25] ;适于多病因肝癌风险分析 aMAP 模型 [26] 和适于一般人群的多个模型 [27] 等,可对风险人群进行分层富集,以提高人群筛查率以及早期肝癌的检出阳性率,具体可参照《原发性肝癌的分层筛查与监测指南(2020 版)》 [28] 。其他的用于评估慢性肝病患者早期转癌风险的预测模型如 IPM 风险指数模型和 GALAD 评分系统 [29] ,在预测早期肝癌(BCLC 0/A)方面均有一定的效能 [30 - 31] 。
THRI 模型纳入了年龄、性别、肝硬化病因(自身免疫性肝病、脂肪性肝炎,未治疗的慢性丙型肝炎或慢性乙型肝炎)以及血小板计数等 4 个参数 , 总计 366 分。低危组(< 120 分)、中危组(120 ~ 240 分)和高危组(240 ~ 366 分)的 5 年肝癌累积发病率分别为 1.2%、4.4% 和 15.4%,10 年肝癌累积发病率分别为 3%、10% 和 32%。THRI 模型在我国也得到较好的验证,归类于低、中和高危组的肝硬化患者,5 年肝癌累积发病率分别为 0、13% 和 34% [32] 。THRI 模型证明在肝癌高危的肝硬化患者中,仍可进一步分出肝癌的极高危人群。THRI 模型虽然灵敏度较高,但特异性却较低。
REACH - B 模型 [18] 参数包括性别、年龄、丙氨酸转氨酶、HBeAg 状态和 HBV DNA 水平,其中评分值 0 ~ 5 分为低危、6 ~ 11 分为中危和 12 ~ 17 分为高危。最低分组(0 分)人群 10 年内的肝癌发生率为零,最高分组(17 分)人群 3、5、10 年内肝癌发生率分别达 23.6%、47.4% 和 81.6%。AGED 模型基于性别、年龄、HBeAg 状态和 HBV DNA 水平4 个参数构建,其高危组(≥ 10 分)20 年内发生肝癌的风险是低危组(≤ 4 分)的 20.3 倍。尤其重要的是,低危组发生肝癌的风险与无 HBV 感染的普通人群已经基本一致,这提示低危组的 HBV 感染者,并无必要和高危组一样接受相同的肝癌监测方案。但该模型是基于一个观察自然转归的队列,未进行过抗病毒治疗,这与我国当前的临床实践不符。PAGE - B 模型用于评估抗病毒治疗后 HBV 感染患者发生肝癌的危险度,包括年龄、性别和血小板计数 3 个参数,但该模型的队列是来自欧洲的慢性乙型肝炎患者,需要在中国人群中进一步验证。
最近,基于全球 11 个前瞻性队列的 17 374 例的慢性肝病长期随访队列而构建的 aMAP 风险模型 [26] ,是中国学者提出的适用于各病种(乙型肝炎、丙型肝炎和脂肪肝等)、各种族(亚洲人、西方人等)的慢性肝病肝癌预测模型。aMAP 评分利用患者的年龄、性别、白蛋白、胆红素水平和血小板这 5 个常见的检验指标,将患者的肝癌发生风险综合评分为 0 ~ 100 分,并将其区分为低风险组(0 ~ 50 分)、中风险组(50 ~ 60 分)和高风险组(60 ~ 100 分),对应的 3 或 5 年的肝癌累积发生率分别为 0/0.8%、1.5%/4.8% 和 8.1%/19.9%。其中,低风险组占总人群约 45%,肝癌年发生风险小于 0.2%,认为可免于频繁肝癌筛查,这样可显著减轻患者经济负担,节省医疗资源。
推荐选用 aMAP 等评分系统作为社区人群肝癌发生风险的评估模型(初筛) [33],提高中国人肝癌知晓率、早诊率,最终降低肝癌病死率。
2. AFP/ 异常凝血酶原(DCP):
AFP 是诊断肝癌的血清标志物之一。中国临床肿瘤学会(CSCO)《原发性肝癌诊疗指南(2020)》指出“AFP 阳性是指 AFP ≥ 400 ng/ml,且排除慢性或活动性肝炎、肝硬化、睾丸或卵巢胚胎源性肿瘤以及妊娠等,高度怀疑肝癌”,但仍有约 30% 的肝癌患者血清 AFP 始终为阴性,且在一些慢性肝炎、肝硬化等肝癌的高危人群中 AFP 也会升高 [5,34] 。肿瘤直径 < 2 cm、>2 ~ < 5 cm 和 > 5 cm 的肝癌中,AFP 阴性(< 20 ng/ml)的比例为 50% ~ 70%、30% ~ 50% 和 20% ~ 30% [35] 。总体上看,AFP 诊断肝癌的灵敏度为 25% ~ 65%,特异性为 80%~94% [35] 。在小肝癌以及早期肝癌的检测中,假阴性较高,作为肝癌的早期筛查指标也不十分理想 [34] 。因此,AASLD 和EASL已不再将AFP作为肝癌筛查、诊断的必备指标 [36 - 37] 。甲胎蛋白异质体 AFP - L3 是肝癌细胞所特有,随着癌变程度的增加相应升高,因此常用 AFP - L3 占 AFP 的百分比(AFP - L3%)作为原发性肝癌的检测指标,可比影像学提前 4.0±4.9 个月发现直径 < 2 cm 的小肝癌(灵敏度 48%,特异性 81%) [38] 。
DCP 又称 PIVKA - II,是伴随肝癌特异产生的异常凝血酶原。作为 AFP 的补充,DCP 对于 AFP 阴性的肝癌具有一定的诊断价值 [34] ,已作为肝癌肿瘤标志物进入临床应用阶段。有研究报道,DCP ≥ 40 mAU/ml 诊断早期肝癌的灵敏度和特异性分别为 64% 和 89%,准确度为 86.3% [39] 。在极早期(BCLC 0 期)和早期 (BCLC A 期)肝癌中,DCP 检出肝癌的比例(55.6%,61.1%)都明显高于 AFP(22.2%,16.7%),对于中晚期肝癌(BCLC B/C 期)的检出比例,DCP 也高于 AFP 但差距变小 [34] 。
AFP 与 DCP 联合检测,可提高肝癌检出的灵敏度和特异性 [39] 。日本将 DCP 联合 AFP、AFP - L3 作为肝癌早期诊断和筛查的标志物 [15,40] 。《中国肝癌诊疗规范(2019)》推荐对血清 AFP 阴性人群,可借助 AFP - L3 和 DCP 联合检测以提高早期肝癌的诊断率。因此推荐 AFP 和 DCP 联合检测作为医院门诊或体检机构肝癌筛查的血清学标志物,提高早期肝癌检出率。
3. 腹部超声(US)/ 磁共振成像(MRI):
US 是肝癌筛查和诊断中应用最广泛的检查。传统超声对临床各期肝癌的诊断灵敏度约为 84%,但对早期肝癌的灵敏度与特异性均较低,分别为 63%(95% CI :48% ~ 75%)和 45%(95% CI :30% ~ 62%);对肝硬化患者早期癌变的检出灵敏度仅为 47%(95% CI :33% ~ 61%) [41] ,联合 AFP 后可明显提升在早期肝癌中检出的灵敏度 [41 - 42] 。
肝癌的发生发展大多遵循从慢性肝炎、肝硬化、肝硬化再生结节(RN)、低级别不典型增生结节(LGDN)、高级别不典型增生结节(HGDN)、极早期肝癌、早期肝癌、进展期肝癌这一过程,这是一个多步骤从分子到临床的演变过程 [43] 。研究结果显示,LGDN 进展为肝癌的 1、3、5 年累积发生率分别为 2.6%、30.2% 和 36.6%,HGDN 进展为肝癌的 1、3、5 年累积发生率分别为 46.2%、61.5% 和 80.8% [44 - 45] 。因此,LGDN 与 HGDN 均被认为是肝癌的癌前病变,而 MRI 对肝脏结节的鉴别诊断有较高的灵敏度和准确性 [46 - 47] 。采用肝细胞特异性对比剂 Gd - EOB - DTPA 增强 MRI 检查≤ 2 cm 肝硬化结节,敏感度、特异性分别为 96.6% 和 92.7% ;MRI 增强扫描对 HGDN 具有高灵敏度(94.7%)和特异性(99.3%),可较准确鉴别早期肝癌和 HGDN [48] 。对 407 例肝硬化患者进行的前瞻性比较研究中,在检出的 43 例肝癌患者中,增强 MRI 的早期肝癌检出率(86%)明显高于 US 监测(27.9%)( P < 0.001);而且,增强 MRI 的假阳性明显低于 US (3.0% 比 5.6%, P = 0.004) [49] 。鉴于增强 MRI 对肝癌及其癌前病变的诊断具有较高的敏感度,在一些国家已被列入肝癌的一线监测和诊断方法 [50 - 51] 。
US 易受操作者经验和患者肥胖的影响,对于早期肝癌的灵敏度低,但其操作简便、灵活、无创和价格低,推荐作为初筛后的人群进行进一步分层富集的工具 ;MRI 用于分层后的高危 / 极高危人群的加强筛查和早期肝癌的影像学诊断。
4. 液体活组织检查 :
(1)cfDNA 全 基 因 组 测 序 :cfDNA 是细胞释放入血的游离 DNA 片段,大量研究证明癌症患者的 cfDNA 中会出现肿瘤相关的变异特征 [52 - 55] ,通过检测血浆中 cfDNA 癌症极早期标志物,可极早期预警癌症风险。利用 cfDNA 全基因组测序(WGS)和 5 - 羟甲基胞嘧啶(5 - hmC)检测技术构建的多组学多维度 HIFI 评分系统,区分肝癌和非肝癌的灵敏度可达 95.42%,特异性达 97.91% [34] 。另一方面,HIFI 诊断模型在 5 - hmC 未诊断出的假阴性案例中同样表现出色 ;对于 AFP 或 DCP 阴性患者,HIFI 检出灵敏度也较高(90.9% ~ 96.9%),大大降低临床漏检率 ;对于极早期(0 期)和早期(A 期)肝癌,HIFI 检测的准确性(88.9%,94.4%)均高于 AFP(22.2%,16.7%) 和 DCP(55.6%, 61.1%)。现有研究数据表明HIFI 评分性能较稳定,重复性高,不受筛查对象肝病史、临床病理特征和地域影响,在筛查和诊断极早期 / 早期肝癌方面的表现优于现有的 AFP/DCP,可作为个体化筛查或诊断的补充。
(2)cfDNA 甲基化 /5 - 羟甲基化 :DNA 表观修饰与肿瘤发生、发展密切相关,且这种改变被认为发生在遗传学改变之前。外周血 cfDNA 的甲基化检测,是近年肿瘤另一种无创早期诊断方法。Xu 等 [56] 检测了 cfDNA 特定位点的甲基化水平,利用 1 098 例肝癌患者和 835 例健康人群的 cfDNA 样本,基于 10 个甲基化基因构建了一个早期肝癌诊断预测模型,灵敏度为 83.3%,特异性为 90.5%。另有研究筛选了 3 个甲基化标记基因(HOXA1,TSPYL5,B3GALT6)和 AFP、年龄构建了一个早期肝癌检测模型,灵敏度为 70%,特异性为 89% [57 - 58] 。在 HIFI 模型构建过程中,通过对肝癌组和健康对照人群进行比较,发现了肝癌中独特的 5 - hmC 修饰位点,并利用这些位点构建分类器,可以很好区分肝癌与非肝癌人群,验证集中的灵敏度 83.16%,特异性 90.50% ;测试集为 77.36%,90.66%,在极早期、早期肝癌的诊断方面也显示出优于血清标志物的较好性能 [34] 。应 用 5hmC - Seal 技术,Cai 等 [59] 从 2 554 例中国人的 cfDNA 样本中获得了全基因组的 5hmC 模式,建立了早期肝癌的 32 基因诊断模型,验证集区分早期肝癌(0/A 期)和非肝癌的灵敏度为 82.7%,特异性为 76.4%。cfDNA 表观遗传学修饰检测有一定的应用潜力,但其灵敏度和特异性还需进一步提升,可以作为个体化诊断的补充。
(3)cfDNA 基因突变 :来源于肿瘤细胞的 cfDNA 被称为 ctDNA。肝癌突变基因包括影响细胞周期(如 TP53)、WNT 信号(CTNNB1 和 AXIN1)或染色质重塑(ARID1A 和 ARID2)等。TERT 启动子区变异在低级别和高级别肝脏增生性结节中经常出现,被认为是肝癌发生的早期分子事件,可作为潜在的辅助临床诊断标志物。一项研究检测了 ctDNA 的 TERT、CTNNB1 和 TP53 基因的 22 个热点突变,发现这些热点突变仅在 3.9%、7.8% 和 3.9% 的肝癌患者中存在 [60] ,当扩大检测范围而不仅限于突变热点时,只有 6 个对照组患者检出突变。肝癌驱动基因不明及异质性高等特性决定了基于 ctDNA 突变的方法来检测早期肝癌,其灵敏度和特异性都面临挑战,但可考虑作为个体化诊断和复发监测的手段。
(4)微小 RNA(miRNA):miRNA 是由 21 ~ 25 个核苷酸构成的非编码小分子 RNA,通过与靶 mRNA 的结合,调节靶蛋白的表达,参与调节肿瘤的发生和发展,具有组织特异性、肿瘤特异性、可由外泌体途径分泌入血及稳定性强等特点。血清 miRNA 作为潜在诊断标志物已取得一定的进展。在一项有 934 例受试者(健康人、慢性乙型肝炎、肝硬化和 HBV 相关的肝癌患者)的研究中,利用血浆样本大规模筛选了 723 个 miRNAs。从中选择 7 个特异 miRNA构建了肝癌的诊断模型,可以区分肝癌与健康人群(灵敏度 83.3%,特异性 93.9%),肝癌与肝炎(灵敏度 79.1%,特异性 76.4%),肝癌与肝硬化(灵敏度 75.0%,特异性 91.1%) [61]。其他类似研究也证明 miRNA 在肝癌诊断中有一定的应用价值,但技术的灵敏度和特异性需进一步改进,其应用价值亦需大样本、多中心临床验证 [62 - 65] ,可作为个体化诊断的补充。
(5)外泌体 :外泌体是直径大约为 30 ~ 150 nm 的包装囊泡,由多种细胞分泌,携带大量蛋白质(如细胞因子、生长因子)及功能性的 mRNAs、miRNAs 等生物活性物质,与多种疾病的发生和进程密切相关。一项研究对 80 例组织学确诊的肝癌患者和 30 例正常对照者进行的血清外泌体 miRNA 分析,发现了 8 个在肝癌和健康人血清样本之间有显著差异的 miRNA,可作为肝癌诊断的标志物 ;同时发现外泌体与肿瘤大小存在显著相关性,携带与不携带 miR -
106a 的患者存在明显的预后差异 [66] 。另一项研究通过对 51 例肝癌和 38 例非肝癌队列的 miRNA 测序(miRNA - seq),比较了肝癌和非肝癌的 miRNA 谱差异,从中鉴定了两对 miRNAs(miR - 584 - 5p/miR - 106 - 3p 和 miR - 628 - 3p/miR - 941)可以区分肝癌患者与非肝癌人群,检测灵敏度为 94.1%,特异性为 68.4% [67] 。证据表明,肝癌特异的外泌体小 RNA 和蛋白信号可能是肝硬化早期恶性转化的有价值的生物标志物,但目前仍缺乏大样本多中心验证其临床应用价值。
推荐筛查方法 :(1)优先推荐 aMAP 等利用易于获取的临床指标构建的肝癌风险评分系统对慢性肝病人群进行分层,提高筛查参与率 ;(2)AFP 作为首选的血清学指标,联合 DCP 和 AFP - L3 可明显提升早期肝癌检出灵敏度 ;推荐 US 为首选的影像学方法,AFP 联合 US 可提高早期肝癌的检出率。MRI 不适宜用于大规模人群筛查,可作为加强筛查或早期肝癌影像学诊断的工具 ;(3)现有液体活组织检查方法在灵敏度、特异性或稳定性方面还面临挑战,尚不能用作为单独手段进行肝癌早筛或监测,可作为个体化筛查或诊断的补充,对高危人群进一步浓缩,筛选出极高危的早期 / 极早期肝癌患者。
三、肝癌早筛的建议流程
专家组建议针对我国人群肝癌早筛采用类似“金字塔”式的精准化分层筛查策略 [28],逐层富集浓缩风险人群,见图 1。
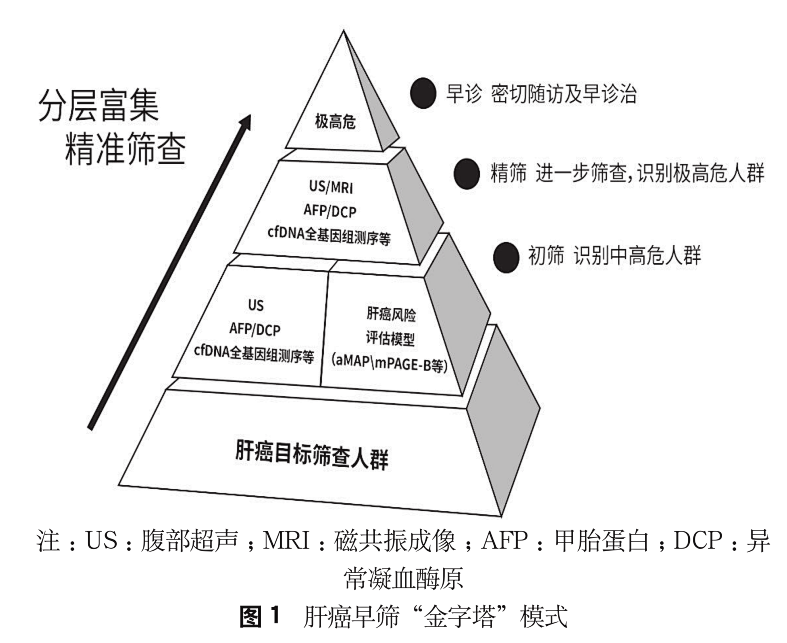
初筛 :对肝癌筛查目标人群的肝癌发生风险进行分层,从中识别出中高风险人群,即初筛。初筛采用的方法可为影像学(US)、血清标志物(AFP/DCP)、肝癌风险评估模型(aMAP [26] 等)以及 cfDNA 全基因组测序等液体活组织检查。对于社区人群推荐利用肝癌风险评估模型进行初筛,根据评分把目标人群分为高危组、中危组和低危组 [26] ;低危组肝癌发生风险与健康人群无差异,可免于每 6 个月 1 次的 US 检查,延长筛查间隔至每 1 年 1 次 US+AFP 检查,从而优化资源配置提高筛查率 ;中危人群建议每 6 个月 1 次 US+AFP 常规筛查以及进一步筛查 ;高危人群建议每 3 ~ 6 个月 1 次 US+AFP 常规筛查以及进一步筛查,或每 6 个月 1 次 MRI 加强筛查。对于医院人群可根据国家卫健委《原发性肝癌诊疗规范(2019 年版)》的规定 [14] ,每 6 个月 1 次 US+AFP 常规筛查以及进一步筛查,或每 6 个月 1 次 MRI 加强筛查。对于有意愿充分评估肝癌发生风险的个体,可与患者充分沟通后,选择 cfDNA 全基因组测序等液体活组织检查完成初筛,cfDNA 全基因组测序结果为低风险的筛查对象,后续推荐每 6 ~ 12 个月 1 次 US+AFP 常规筛查以及进一步筛查,检测结果为高风险的筛查对象则按极高危人群进行管理和监测。
精筛 :对于初筛的中高危人群,其肝癌或癌前病变的发生风险明显升高,因此建议对这部分人群进一步筛查以富集出极高危人群,即精筛。精筛可采用 US/MRI、AFP/DCP 或 cfDNA 全基因组测序等液体活组织检查方法。根据《原发性肝癌二级预防指南(2021 年版)》 [68] ,如果 US 发现≤ 2 cm 结节或不典型占位性病变,则肝癌发生风险等级升为极高危 ;如果 AFP 阳性(≥ 20 ng/ml),或伴有 DCP ≥ 40 mAU/ml 或 AFP - L3 ≥ 15%,则肝癌发生风险也升为极高危 ;如果 cfDNA 全基因组测序结果为高风险,则提示肝癌发生风险升级为极高危。
早诊:根据《原发性肝癌二级预防共识(2021 年版)》 [68] ,极高危人群实施最严密的分层管理和监测时间间隔,推荐每 3 个月 1 次 US+AFP 常规筛查,6 个月 1 次 MRI 加强筛查。对 US 检出≤ 1 cm 结节的患者,需观察结节大小的变化和影像学特征的改变,因此每 3 个月需 US 复查,如结节增长或结节在 1 ~ 2 cm 且 AFP > 20 ng/ml 应启动肝癌加强筛查流程,优选采用肝胆特异性对比剂的增强 MRI 以鉴别结节性质。如果影像学检查不能确定结节或病变性质者,可考虑在影像引导下行诊断性肝穿刺活组织学检查。
每一个筛查周期,需要对筛查对象进行风险评估,如果评估结果无变化,则维持原定监测方法和周期 ;如果风险增加,需相应提高分层等级并执行新层级的监测方案。最终通过初筛、精筛、早诊逐级浓缩的金字塔模式,提高早期肝癌检出效率。