

《Tumor公社》 肿瘤医学开放式媒体平台,打造肿瘤医学领域一站式解决方案,致力于为用户公众及患者提供及时、全面的肿瘤资讯、科普知识。看百科、找医生、指南分享、搭建医生与患者、患者与患者之间的桥梁,让更多人了解肿瘤、认识肿瘤、助力健康中国2030规划纲要,推动全面科学素质普及,共建肿瘤医学科普生态圈。




专注肿瘤专家报道,专注肿瘤人文报道,全面、细致、详实的让你了解每一位肿瘤领域大咖。

中国抗癌协会早癌筛查科普教育基地官方账号
2024年欧洲肿瘤内科学会乳腺癌年会(ESMO BC)于当地时间5月15日至17日在德国柏林会展中心以线上线下形式同步盛大召开。作为乳腺肿瘤领域极具权威的国际盛会,2024 ESMO BC汇聚了来自全球的乳腺癌领域最新、最具影响力的研究成果。由山东省肿瘤医院于金明院士、王永胜教授牵头开展的一项大型、非劣效性、中国真实世界研究成果在本次大会中重磅公布(摘要号:123P)。结果显示,在绝经前或围绝经期激素受体阳性(HR+)总人群及所有亚组中,戈舍瑞林10.8mg 3月长效剂型在雌二醇(E2)抑制效果方面非劣于戈舍瑞林3.6mg 1月剂型[1]。
这项超1.5万例乳腺癌患者的真实世界研究填补了促性腺激素释放激素激动剂(GnRHa)长效剂型在中国应用数据相对有限的不足,同时进一步证实戈舍瑞林10.8mg长效缓释植入剂疗效非劣于戈舍瑞林3.6mg 1月植入剂,提高用药便利性,以戈舍瑞林为基础的联合方案是HR+乳腺癌患者的标准治疗选择,可降低复发风险和死亡风险,提高乳腺癌患者治愈可能。医学界肿瘤频道特邀王永胜教授对该研究结果进行深入解读。
相较于西方国家,我国乳腺癌患者在确诊时通常较年轻,约50%处于绝经前状态[2,3]。绝经前乳腺癌患者往往表现出与预后不良相关的临床病理学特征,如肿瘤分期较高、淋巴结阳性和肿瘤体积较大等[4]。卵巢功能抑制(OFS)联合内分泌辅助治疗方案是降低这类患者复发风险的标准选择[5]。作为一种有效的OFS疗法,戈舍瑞林10.8mg 3月长效剂型相较于3.6mg 1月剂型,为绝经前HR+乳腺癌患者带来了更多便利,降低了访视次数和临床医生负担。然而,在中国乳腺癌患者中,关于比较戈舍瑞林10.8mg剂型与3.6mg剂型的大型真实世界研究数据尚且有限。因此,使用我国乳腺癌患者的8年数据,开展该大型真实世界研究以填补这一循证空白。
这项多中心、回顾性、前瞻性、观察性研究(NCTO5184257)纳入≥18岁、诊断为乳腺癌、接受戈舍瑞林10.8mg 或3.6mg 治疗、于第8-28周内进行E2水平检测的绝经前或围绝经期患者。排除了同时接受其他可能干扰E2水平治疗的患者。通过倾向性评分匹配(PSM)确保了基线可比性。主要终点为第12±4周时,E2降低至绝经后水平的患者比例。非劣效性边界为-10%。同时进行亚组和敏感性分析评估混杂因素效应和结果的稳健性。
1研究人群和药物暴露情况
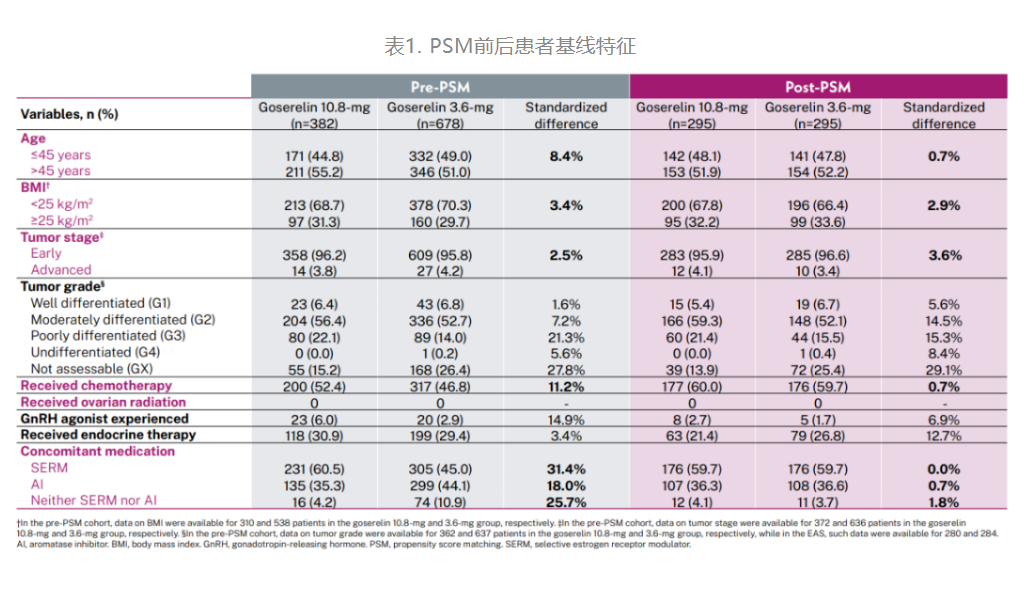
在对15,629名患者进行筛选后,共纳入1060例符合条件的患者,其中382例接受戈舍瑞林10.8mg治疗,678例接受戈舍瑞林3.6mg治疗。PSM后,每组各295例患者。
两组基线特征在PSM后更加相似,匹配变量中的最大标准化差异为3.6%。PSM前后的基线特征见表1。
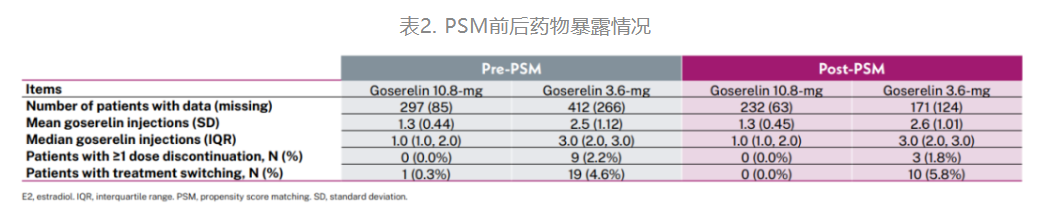
药物暴露情况见表2。PSM后,主要终点E2检测(12±4周)前戈舍瑞林10.8mg组的中位治疗次数为1次,而3.6mg组为3次。
2疗效结果
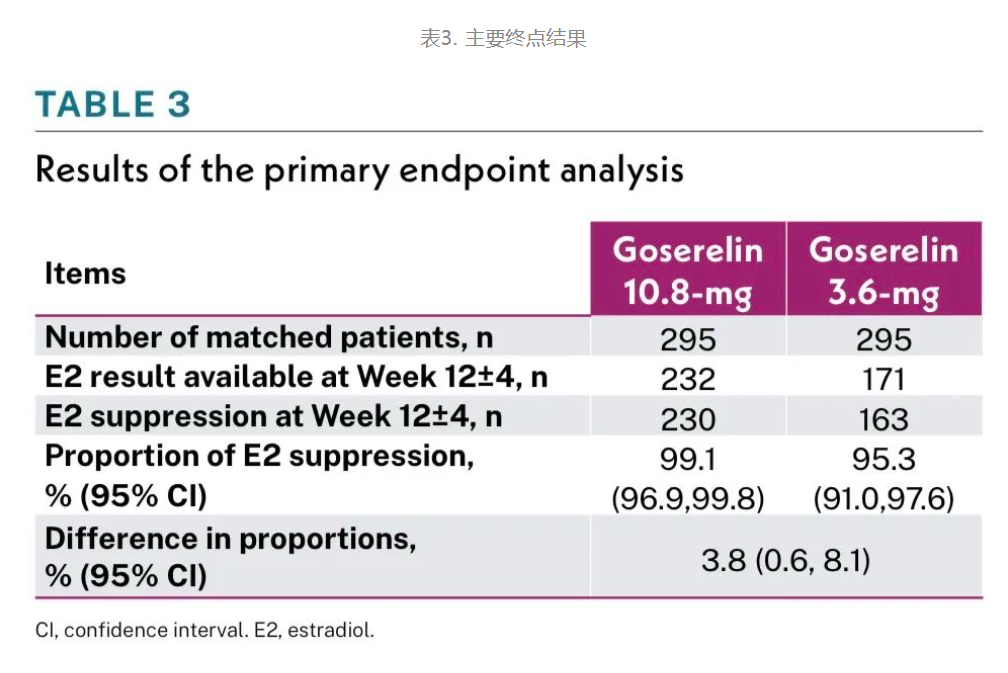
在第12±4周时,戈舍瑞林10.8mg组E2降低至绝经后水平的患者比例为99.1%,3.6mg组为95.3%,差异为3.8%(95%CI:0.6%-8.1%),95%CI的下限大于非劣效性边界-10%,确证了戈舍瑞林10.8mg与戈舍瑞林3.6mg的非劣效性。
所有对主要终点的敏感性分析,包括①在第4周至第16周时所有评估中E2抑制的患者比例(每组n=295);②排除在10.8mg和3.6mg剂量组转换的患者;③仅匹配在第12±4周E2水平检测前接受戈舍瑞林10.8mg一次或戈舍瑞林3.6mg三次的患者;④根据第12±4周E2检测前的最后一次剂量重新定义剂量组(每组n=320);⑤对于戈舍瑞林3.6mg组,仅纳入接受≥2次治疗的患者(每组n=279);⑥仅匹配第12±4周未丢失E2检测结果的患者(每组n=212);⑦使用逆概率加权(IPTW)代替PSM(10.8mg组:n=382,3.6mg组n=678);⑧分析所有符合条件的患者(10.8mg组n=382,3.6mg组n=678),均支持戈舍瑞林10.8mg非劣效于戈舍瑞林3.6mg(表4)。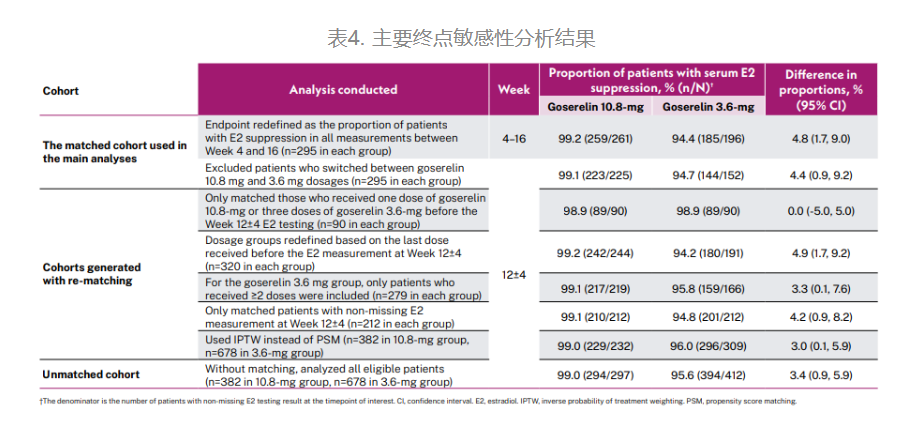
在所有亚组中,包括基线年龄(≤45岁、>45岁)、BMI(<25kg/m2、≥25 kg/m2)、既往是否接受过化疗(是、否)、肿瘤分期(早期、晚期)、合并用药等方面,每个戈舍瑞林剂量组在第12±4周的E2降低至绝经后水平的患者比例均较高。每个亚组结果与主要分析结果一致。
3研究结论
这项大型真实世界研究采用严谨的设计验证了戈舍瑞林10.8mg长效缓释植入剂型在中国绝经前或围绝经期HR+乳腺癌患者中非劣效于戈舍瑞林3.6mg剂型。多项敏感性分析和亚组分析与主要分析结果一致,证实其稳健性和可靠性。
根据全国肿瘤登记中心收集的肿瘤登记数据,2022年中国乳腺癌新发病例为35.72万例,在女性肿瘤中排名第二;死亡约7.5万例,在女性肿瘤中排名第五[6]。并且,近年来,中国年轻乳腺癌患者的比例呈上升趋势。中国乳腺癌患者中近一半在诊断时处于绝经前状态[2,3],与绝经后乳腺癌相比,绝经前乳腺癌更具侵袭性,复发风险更高,且预后更差[4]。
OFS能将绝经前HR+乳腺癌的激素水平维持在绝经后水平,从而降低乳腺癌的复发和转移风险,是绝经前HR+乳腺癌患者内分泌治疗的重要选择。目前,国内外多部权威指南均推荐中高危患者行OFS治疗,国外多部指南及《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2024年版)》将化疗指征这一风险因素作为OFS的适用判断标准之一,便于临床实践中对于OFS获益人群的识别。而在OFS方式和选择方面,则推荐药物去势(GnRHa)作为绝经前HR+早期乳腺癌OFS的首选[5,8-9]。
在中国获批乳腺癌适应证的GnRHa中,戈舍瑞林是唯一联合他莫昔芬(TAM)与TAM单药头对头比较有显著获益的OFS药物。ASTRRA研究显示,戈舍瑞林+TAM组的8年DFS率相较TAM单药组继续显著下降(85.4% vs 80.2%,HR=0.67),8年的DFS绝对获益为5.2%[10]。另外,STO-5研究证实,在绝经前HR+早期乳腺癌患者中,戈舍瑞林(HR=0.49)、TAM(HR=0.57)或戈舍瑞林+TAM(HR=0.63)治疗相比无辅助内分泌治疗的对照组显著改善了长期无远处复发间隔,是唯一证实GnRHa可为绝经前HR+乳腺癌患者带来20年长期获益的大型、随机对照研究[11]。
并且,多项研究已证实戈舍瑞林10.8mg长效3个月剂型的有效性及安全性非劣效于戈舍瑞林3.6mg 1月剂型。在日本进行的II期研究、在亚洲开展的III期研究均证实戈舍瑞林10.8mg非劣效于戈舍瑞林3.6mg[12,13]。2022年ESMO大会中发布的一项研究显示,戈舍瑞林10.8mg与戈舍瑞林3.6 mg具有相似的DFS、PFS和毒性谱,但长效针剂更方便,注射次数更少,减少患者就医次数,节约医疗卫生资源[14]。2023年ESMO BC大会中则公布了一项戈舍瑞林10.8mg与戈舍瑞林3.6mg非劣效性比较的真实世界研究,共纳入240例患者,结果显示,戈舍瑞林10.8mg 3月剂型具有更强的卵巢功能抑制作用,其对E2抑制率达98.96%[15]。
GnRHa 3月长效剂型已被国内外多部权威指南提及和推荐[5,8-9],为绝经前HR+乳腺癌提供了新的治疗选择。而本次ESMO BC公布的这项真实世界研究在更广泛的中国患者中验证了戈舍瑞林10.8mg与戈舍瑞林3.6mg的非劣效性,填补了GnRHa长效剂型在中国应用数据有限的不足,对于改进我国乳腺癌临床诊疗实践,优化患者治疗方案具有重要意义。
当前,国内外多部权威指南均建议乳腺癌患者接受5-10年的内分泌治疗。在乳腺癌长期管理中,提高用药便利性和患者长期依从性成为临床亟需解决的重要问题。戈舍瑞林10.8mg长效剂型的应用为乳腺癌患者带来了更为便捷的治疗方案,显著减少给药频次,大幅度减轻治疗对患者日常生活的影响,从而提高其长期依从性。患者无需频繁就诊,得以更多时间和精力规划生活,关注自身身心健康,保持积极乐观的生活态度,以更好地应对治疗过程中的种种挑战,进而为其带来更多治愈可能性,为实践“健康中国2030”注入新的动力。从舒适医疗到疾病治愈,我们坚信,随着医学技术的不断进步和临床实践的持续优化,将为更多患者提供更优质的治疗和关怀。