

《Tumor公社》 肿瘤医学开放式媒体平台,打造肿瘤医学领域一站式解决方案,致力于为用户公众及患者提供及时、全面的肿瘤资讯、科普知识。看百科、找医生、指南分享、搭建医生与患者、患者与患者之间的桥梁,让更多人了解肿瘤、认识肿瘤、助力健康中国2030规划纲要,推动全面科学素质普及,共建肿瘤医学科普生态圈。




专注肿瘤专家报道,专注肿瘤人文报道,全面、细致、详实的让你了解每一位肿瘤领域大咖。

中国抗癌协会早癌筛查科普教育基地官方账号
药物创新真的不容易,李宁院长表示,每年全球CNS刊物发表肿瘤相关各类研究数量5000+;每年全球各类刊物发布肿瘤三期临床研究数量300+;每年FDA批准扩展适应症药物50+;每年FDA批准的新药物20-;在ClinicalTrials.gov上出现的化合物,只有3.8%的几率获批上市。谈到创新难的原因,李院长用了如下几个不等式进行了非常详尽的阐述和分享。

医学博士,主任医师;
临床研究国家质量评价和促进中心(肿瘤领域)常务副主任;
主要研究方向:致力于肺癌微创治疗、靶向生物治疗,肿瘤临床科研设计、开展,抗肿瘤新药、新技术临床试验管理和推动。以第一、通讯作者在Lancet Oncology、Jama Oncology、Cancer Cell等学术刊物上发表文章数十篇,累计影响因子400余分;作为课题负责人承担国家自然科学基金,973分课题等多项研究,中国医学科学院临床试验能力提升平台(GCP)首席专家。
一好药不代表好疗效
在肿瘤学界打开精准医疗大门的 EGFR·TKI药物吉非替尼·易瑞沙,这是AZ的一个创新性药物,在研发过程中一波三折。吉非替尼通过II期研究加速获批用于治疗所有含铂化疗失败后的非小细胞肺癌患者,,但做确证性临床研究时,吉非替尼组却并显示生存优势,也因此撤市。。但是亚组分析发现这个药物对于一部分患者(亚裔、不吸烟、女性患者)确实有效,随后的研究发现吉非替尼仅适用于EGFR突变人群,而在上述人群中EGFR突变的发生率更高,其后吉非替尼又进行了几次大规模临床试验明确证实了上述结论得以在美国、欧盟再次上市。目前也是各大指南推荐的EGFR敏感突变患者的标准一线治疗用药。
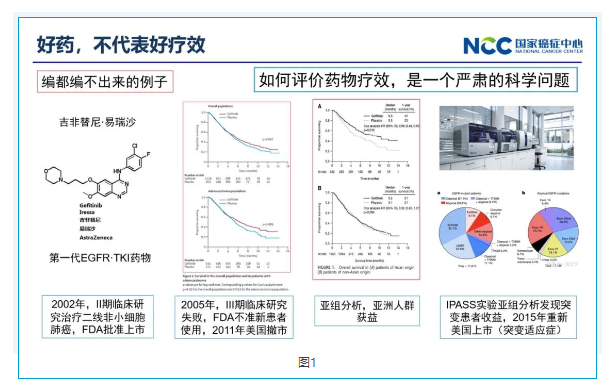
二好疗效,不代表好结果
2023年FDA召开了一次会议,公开宣布在血液肿瘤中,PI3K抑制剂已经不再接受单臂优先审评上市。这一类药物在惰性淋巴瘤以及非霍奇金淋巴瘤中取得了缩小肿瘤的良好效果,ORR、PFS显著提高,但是在总生存时间这个结果甚至劣于安慰剂。试验组的OS受损,即药物虽然可以缩小肿瘤,但却可能引起比较严重的副作用。特别是在很惰性的、老年人患者中,副作用的危害可能会大于肿瘤缩小带来的优势。
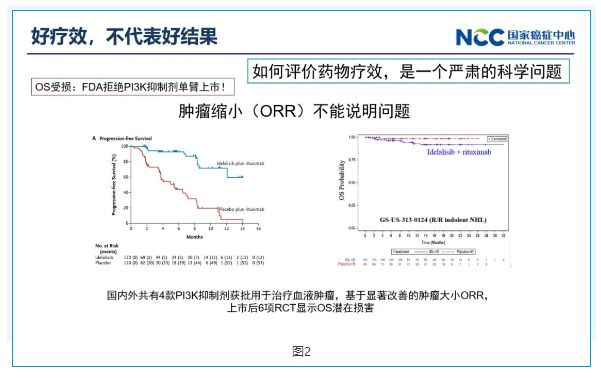
三好结果,不代表好科学
2023年ODAC会议把一项PARP抑制剂奥拉帕利一线联合治疗前列腺癌的临床试验重新拿出来,这项研究当时做全人群得到了很好的PFS和OS等结果,包括相关论文也发表在新英格兰上。FDA这次把每个患者的数据拿出来进行分析,把纳入的所有人群分成了Brca突变组、Brca未突变组、Brca状态不明三组,发现仅Brca突变组患者获益,而绝大多数没有 Brca突变这部分人群,其效果与安慰剂一样。最后FDA对于没有科学基础依据的这一部分患者人群,拒绝了这个药物的适应症获批,而是仅批准了Brca突变这一部分人群的适应症。
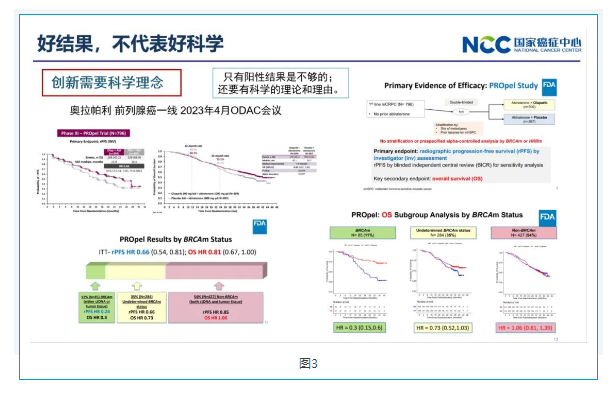
四好科学,不代表好研究
索托拉西布(AMG510)是一个划时代的药物,打破了Kras 40年不可成药位点的魔咒。这个概念发布以来就受到万众瞩目,一期、二期临床都进入了新英格兰,这个药物还获得了FDA的4个加速通道(加速批准,突破性疗法认定,快速通道资格,优先审评资格)。虽然科学上无可置疑,但对于研究方法,认为优先审评之后,确证性临床研究没有设盲法,导致入组之前20%左右的患者脱落,产生了随机偏移。另外对于PFS评估,研究者评估的PFS明显偏袒试验组。并导致部分影像学重新阅片,最后ODAC会议以2票赞成,10票反对,拒绝此药上市,要求重新做确证性临床研究。

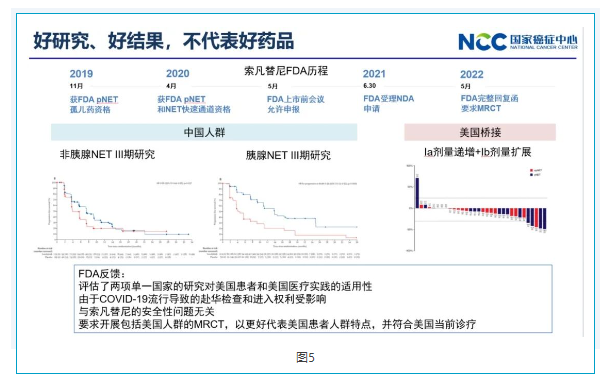
五好研究、好结果,不代表好药品
和黄在索凡替尼这个药物的上市进程中,与FDA的沟通非常规范,具体见图5。这个药物的两个适应症(非一线NET神经内分泌肿瘤和胰腺神经内分泌肿瘤)都获得了很好的结果。在美国上市之前,也去美国做了桥接试验。一个Ia计量递增和Ib计量拓展也获得了相同的结果,可以说能做的几乎都做到了。FDA评估了两项单一国家的研究对美国患者和美国医疗实践的适用性,由于COVID-19流行导致的赴华检查和进入权利影响,要求开展包括美国人群的MRCT,以更好代表美国患者人群特点,并符合美国当前诊疗。之前有PD-1就成功了,所以说按照以前有的规则去做一款创新药时,这条路不一定可以走通。
六创新难,如何迎难而上!
我们做创新药,不但要在靶点创新,在机制创新,还要在整个方案设计等一系列方面都有一个创新的思路。创新是一个非常庞大的体系,这个体系在中国从2015以后有飞速发展,这种发展更多的是量上的发展。一个蚂蚁想增重,它如果按照原来的头、胸、腹的比例,肯定会被自己压死。它如果要增到大象那样的体重,就必须要有大象的身体比例分配。
创新的体系包括政策、评价、应用、机制、制剂、支付、社会、设计,还需要大家对创新的理解更加精确。比如肿瘤领域的创新药物可以细分成几类。其中一类是已知靶点的创新,已知靶点不是说不能创新,EGFR突变,我们有一代的吉非替尼,三代的奥希替尼,同样的靶点在不同的分子结构之下,我们可以使寿命延长1-2年,这也是创新。Her2靶点发现了这么长时间,我们仍然有ADC药物出现。同样靶点下有不同的创新药,可以达到不同的疗效,这些在我们临床应用上都认为是创新,这些可能是大药厂去做的。我们中国现在是以跟随创新为主,当然我们现在也一直在鼓励靶点创新。
不同种类的创新对药物研发的影响,不仅限于名誉方面,更关键的是体系、思路和模式的差异,不能拿同样的方式去做跨领域的研发。我们前一段时间曾经列举了十大“未”成功临床试验,是LEAP系列+KEYNOTE。LEAP现在已知的这几项结果显示都没有达到预期的终点。如果按照我们的审评标准就都失败了,但是大家知道 Leap这一系列试验是默沙东(被称为全球药王)自己做的。他们产品管线丰富,临床试验多,经验丰富。为什么还会有这么多的失败,因为创新就会伴随失败。
创新药物研发过程是一条非常长的纵向链条,时间跨度、专业跨度、投资运营跨度、管理模式跨度都很大。既往分而治之的模式,已经不适合于目前快速见效的实际要求,如何能把纵向链条转变成多维回路,节约资源、提高效率是每一个临床研发从业者的目标和职责。我们应坚持创新驱动发展,以临床试验曾质提速为目标,聚集投资方、创新企业、临床CRO、医院管理者、研究医生,采用分享和探讨各方发展的方向、面临的关键问题及对行业的期望等,在平等交流的平台上开放讨论,以寻求共建新型药物研发模式的解决方案。
李进院长建立了中国第一批研究型医院,这是一个标志性分工的开始,我们没有建立那样的医院,但是我们医院内部在赫院长指示之下,也从2017年开始建立了专职临床研究团队,团队成员都是毕业于清华、北大等中国高等学府,并担任专职临床研究工作。
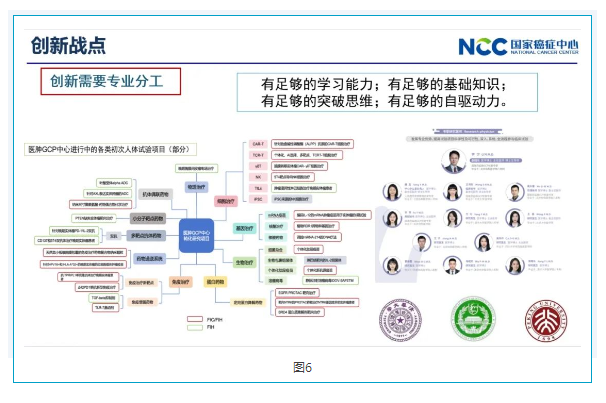
左边是我们中心现在承接的一些First-in-Class,First-in-Human项目。这些研究和临床三期的临床研究完全不一样。三期临床研究是Follow the Protocol,而我们要 Change the Protocol,每天都要和研发人员、研发科学家们进行沟通。这是非常非常艰难的,但只有这样才能把科学故事做好。所以临床需求既是终点也是起点,要做一个药物并不是药好就行了。
临床研究评价体系实际上非常重要。有一个很有意思的研究,在做二期临床研究的时候, RCT到三期临床研究只有25%的成功率。这一部分到底是药不好,还是我们没有选好。我相信任何一个走到三期的药物,绝对不是对任何患者都无效,还是有一定比例患者获到了疗效。怎样把它用好是我们临床研究者的工作。统计学是做多次检验,最后得到确定结果,但临床研究是一锤子买卖,很多东西只有一次机会。
原始创新意味着独自率先登上了一座基础研究的顶峰。创新的转化是遥遥相对的另一座高峰。愿我们多方共同合作,不断跨越一座有一座高峰!