

《Tumor公社》 肿瘤医学开放式媒体平台,打造肿瘤医学领域一站式解决方案,致力于为用户公众及患者提供及时、全面的肿瘤资讯、科普知识。看百科、找医生、指南分享、搭建医生与患者、患者与患者之间的桥梁,让更多人了解肿瘤、认识肿瘤、助力健康中国2030规划纲要,推动全面科学素质普及,共建肿瘤医学科普生态圈。




专注肿瘤专家报道,专注肿瘤人文报道,全面、细致、详实的让你了解每一位肿瘤领域大咖。

中国抗癌协会早癌筛查科普教育基地官方账号
近日,基于DESTINY-PanTumor02、DESTINY-Lung01和DESTINY-CRC02试验中HER2阳性IHC 3+亚组肿瘤患者的数据,FDA加速批准Enhertu(德曲妥珠单抗,DS8201)用于治疗既往接受过全身治疗且没有令人满意的替代治疗方案的不可切除或转移性HER2阳性(IHC 3+)实体瘤成人患者。
DESTINY-PanTumor02为一项全球多中心临床开放标签的II期临床试验,旨在评估DS8201用于治疗局晚期、不可切、经多线治疗后发生转移的实体瘤患者的疗效和安全性。所有受试者Her-2表达均为阳性。包括宫颈癌、子宫内膜癌、卵巢癌、胰腺癌、胆道癌、膀胱癌、和罕见肿瘤。主要研究终点:ORR(客观缓解率)次要研究终点:DoR(缓解持续时间)、疾病控制率、无进展生存期、总生存期、安全性、耐受性和药代动力学。
结果显示,中位随访9.7个月(中位DoT 5.5个月)时,在总共267位患者中,总人群的ORR达到37.1%,DCR68.2%,中位DoR达到11.8个月。
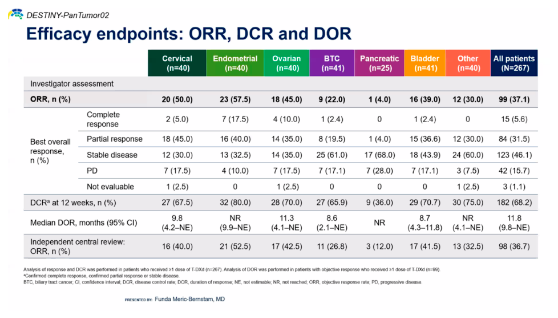
而且在HER2 2+和3+的整体人群中均表现出显著疗效:对于HER2 2+的人群,ORR为27.2%,中位DCR为9.8个月;HER2 3+人群的ORR为61.3%,中位DCR为22.1个月。
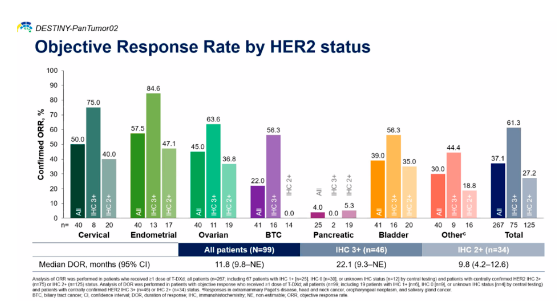
精准诊疗时代,肿瘤治疗基于生物标志物而非肿瘤类型已经成为一种趋势,除了DS8201,美国食品药品监督管理局(FDA)还批准过七大不限癌种的疗法,让我们一起回顾一下吧。
1.帕博利珠单抗(pembrolizumab,K药)与MSI-H/dMMR
高微卫星不稳定性或错配修复基因缺陷型(MSI-H/dMMR)癌细胞拥有比正常细胞更多的遗传标记物,被称之为 “微卫星”。它们是短的重复性DNA序列。通常当细胞复制DNA时会修复错配的 DNA,拥有大量微卫星的癌细胞可能在这一功能上有缺陷(也被称之为错配修复缺陷,或dMMR)。MSI-H/dMMR肿瘤最常见于子宫内膜癌、结直肠癌和胃肠癌,也可能出现在乳腺癌、前列腺癌、膀胱癌及胸腺癌患者中。
2017年5月,FDA批准帕博利珠单抗(K药)用于高度微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)的实体肿瘤患者,这是第一次按照biomarker而非特定瘤种批准适应症。也正式从官方层面开创了分子标志物引导的泛癌种治疗时代!
2.拉罗替尼(larotrectinib)与NTRK基因融合
神经营养性酪氨酸受体激酶(NTRK)是目前首个被发现并被认可的全癌种共发的可用药的突变基因,在多种肿瘤中都有发现,在常见肿瘤肺癌、结直肠癌中的发病率低于5%,但多出现于成人和儿童实体瘤中,包括乳腺类似物分泌癌(MASC)、甲状腺癌、结肠癌、肺癌、胰 腺癌、及各种肉瘤等。
FDA在2018 年11 月批准了拜耳/Loxo 的拉罗替尼(Larotrectinib,商品名:Vitrakvi)。
根据2021年ASCO的最新研究进展来看,在一个3项临床试验中,共纳入了218例患者接受larotrectinib治疗,其中206例可评价疗效。有21种不同的肿瘤类型,其中肺癌占总比例的9%。患者的中位年龄为38.0岁。所有患者均接受过大量预治疗,45%的患者既往接受过≥二线的全身治疗;27%的患者既往未接受过全身治疗。其中ORR为75%(95%CI 68-81):CR为22%,PR为53%,SD为16%,PD为6%;中位缓解持续时间(DoR)为49.3个月(95%CI 27.3–无法估计);中位PFS为35.4个月(95%CI 23.4-55.7);未达到中位总生存期(OS)。
3.恩曲替尼(entrectinib)与NTRK基因融合
2019年8月15日,FDA宣布批准entrectinib(恩曲替尼)上市,用于治疗NTRK基因融合阳性的晚期复发实体瘤成人和儿童患者,同时,FDA还批准恩曲替尼用于治疗携带ROS1基因突变的转移性非小细胞肺癌。柳叶刀发表文章汇总了三个I/ II期研究中鉴定并分析了总共54例先前未接受TRK靶向治疗的NTRK融合阳性肿瘤患者。整体人群的ORR为57.4%(31/54),中位无进展生存期(PFS)和总体生存期(OS)分别为11.2个月和20.9个月。在肺癌亚组效果也很抗打。
4.K药与TMB-H
肿瘤突变负荷(tumor mutational burden, TMB):是测量某种肿瘤体细胞内编码蛋白的平均1Mb范围内的碱基突变数量,包括基因编码错误、碱基替换、基因插入或缺失等各种形式的突变。
TMB的量化可分为3类:
1)高:TMB-High=>20mutations/Mb;
2)中:TMB-Intermediate,6-19 Muts/Mb;
3)低:TMB-Low <= 5 Muts/Mb;。
2020年,FDA批准pembrolizumab(俗称“K药”)“不限癌种”的新适应症:单药治疗不可切除或转移性的,具有高组织肿瘤突变负荷(TMB-H)≥10个突变/Mb的,成人和儿童实体瘤患者(既往治疗后疾病进展且没有更佳替代疗法)。
5.多塔利单抗(dostarlimab-gxly)与dMMR
2021年8月18日,FDA加速批准了dostarlimab-gxly (Jemperli) 用于治疗实体瘤免疫治疗中错配修复缺陷(dMMR)成人患者。
此次获批是基于一项正在进行的、多中心、非随机、多个平行队列、开放标签的研究GARNET 试验,其中的dMMR子宫内膜癌队列 A1 和 dMMR 实体瘤、非子宫内膜癌队列 F 正在进行的 GARNET 1 期试验 (NCT02715284) 的数据基础。纳入A1 队列的患者需要在先前使用含铂方案治疗时或之后出现进展,入选队列 F 的患者必须在全身治疗后取得进展,并且没有获得任何令人满意的替代治疗选择,结直肠癌患者在使用氟嘧啶、奥沙利铂和伊立替康后疾病进展或不耐受。
研究结果表明,该药物在所有 dMMR 实体瘤[包括子宫内膜和非子宫内膜实体瘤(n = 209)]客观缓解率(ORR)为41.6%(95% CI,34.9-48.6),其中部分缓解 (PR) 率32.5%;中位反应持续时间 (DoR) 为34.7个月(范围 2.6-35.8+),95.4%的患者出现反应持续6个月或更长时间。
6. 达拉非尼 +曲美替尼与BRAF V600E 突变
2022年6月,FDA 加速批准 达拉非尼 (Tafinlar) 联合曲美替尼 (Mekinist) 用于治疗 6 岁及以上 BRAF V600E 突变的不可切除或转移性实体瘤患者。
在BRF117019(ROAR)和NCI-MATCH的H组研究中,共131名成人患者,包括24种肿瘤类型,达拉非尼+曲美替尼在携带BRAF V600E的实体瘤患者中达到高达80%的总缓解率(ORR)。在最具代表性的肿瘤类型中,胆道癌的ORR为46%,高级别胶质瘤(合并)和低级别胶质瘤(合并)的ORR分别为 33%和 50%。
7. 塞尔帕替尼与RET融合
2022年9月21日,selpercatinib(塞尔帕替尼)新适应症获FDA加速批准,用于治疗转染重排(RET)基因融合的局部晚期或转移性实体瘤患者。
LIBRETTO-001试验入组了 41名非小细胞肺癌和甲状腺癌以外RET融合阳性的各类实体瘤患者,包括胰腺癌、结直肠癌、唾液腺癌、肉瘤等14类癌症。这些患者都是经过了平均两种治疗方案失败的临床难治型患者。结果显示,总体缓解率 (ORR) 为 44%,疾病控制率高达77%。
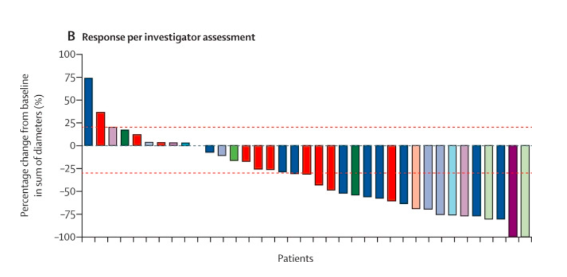
响应良好的肿瘤类型包括了胰腺腺癌、结直肠癌 (CRC)、唾液腺癌、未知原发性癌、乳腺癌、软组织肉瘤、支气管类癌、卵巢癌、小肠癌和胆管癌。
比如:
在 11 名胰腺腺癌患者中,该药物的缓解率 (ORR) 为 55%;
在 10 名 结直肠癌患者中,缓解率 (ORR) 为 20%;
在4名唾液腺癌患者中,缓解率 (ORR) 为 50%;
在 3 名原发性癌症未知的患者中,缓解率 (ORR) 为 33%。
参考来源:
https://www.targetedonc.com/view/fda-approves-trastuzumab-deruxtecan-in-her2-solid-tumors
声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。